當(dāng)前位置:新聞 > 正文
國家藥監(jiān)局:保障新冠病毒抗原檢測試劑市場供應(yīng)
《公告》要求,新冠病毒抗原檢測試劑注冊人要認(rèn)真貫徹落實(shí)《醫(yī)療器械監(jiān)督管理?xiàng)l例》及其配套規(guī)章,,全面落實(shí)企業(yè)產(chǎn)品質(zhì)量安全主體責(zé)任,,持續(xù)加強(qiáng)產(chǎn)品上市后研究,并在注冊證有效期期屆滿前完成附條件批準(zhǔn)要求的相關(guān)工作,,及時(shí)提出延續(xù)注冊申請,。
同時(shí),各省級藥品監(jiān)督管理部門要切實(shí)加強(qiáng)對新冠病毒抗原檢測試劑產(chǎn)品的上市后監(jiān)管,,強(qiáng)化監(jiān)督檢查和監(jiān)督抽檢,,監(jiān)督注冊人嚴(yán)格按照質(zhì)量管理體系和產(chǎn)品技術(shù)要求組織生產(chǎn),保障產(chǎn)品質(zhì)量安全。
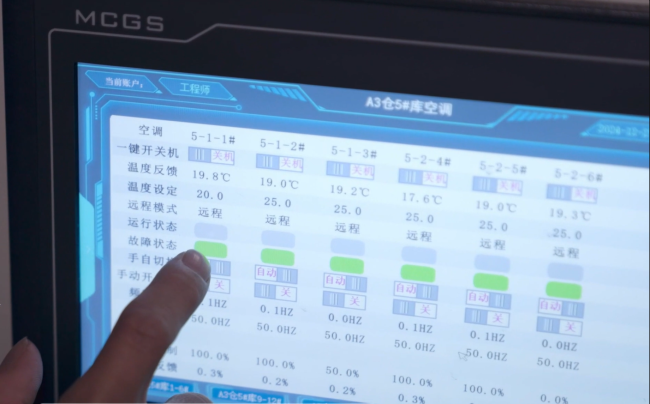
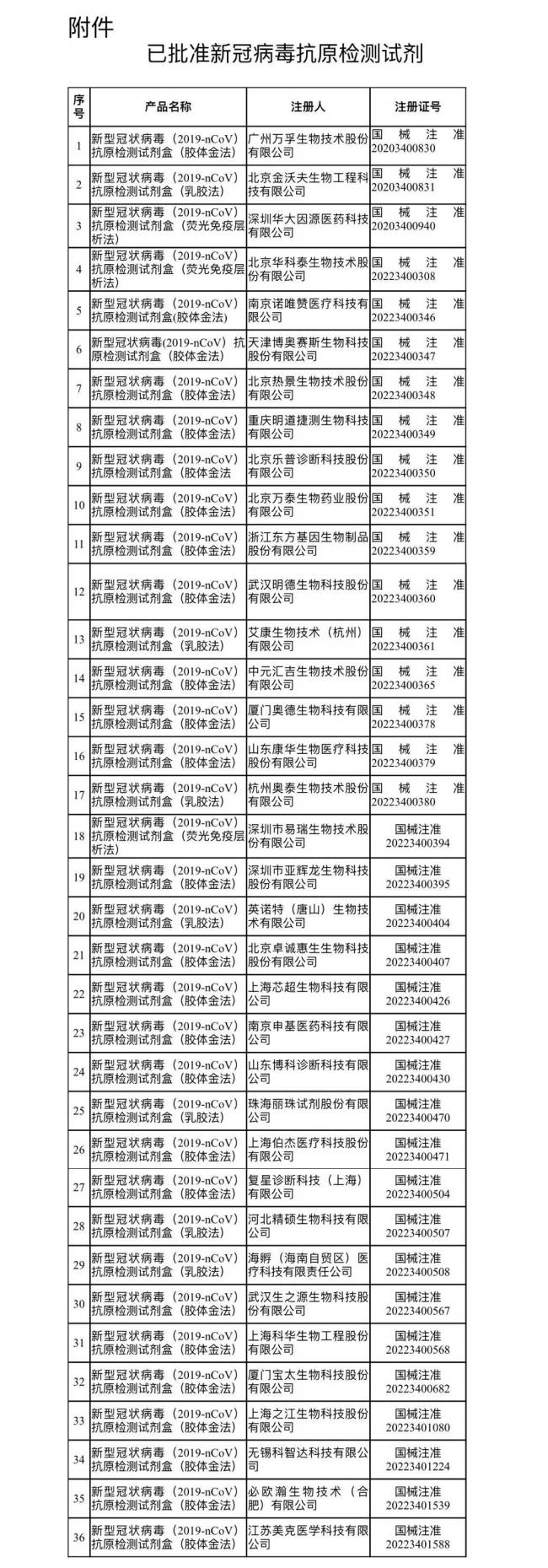
國家藥監(jiān)局表示,,截至目前,,國家藥監(jiān)局已經(jīng)批準(zhǔn)36個(gè)新冠病毒抗原檢測試劑,藥品監(jiān)督管理部門將繼續(xù)加快相關(guān)產(chǎn)品審評審批,,加強(qiáng)相關(guān)產(chǎn)品上市后監(jiān)管,,確保產(chǎn)品質(zhì)量安全。
推薦閱讀

山村里的“摩托老師”(暖相冊)
人民網(wǎng)-人民日報(bào)2023-03-29 06:11:22
“洋專家”對話中國市長|Ep.1人怎么選,?
新華社2023-03-28 23:20:59
新華社權(quán)威快報(bào)丨2022年度全國十大考古新發(fā)現(xiàn)公布
新華社2023-03-28 11:21:19
梅西曬與女歌手牽手照片 “安妞”這都不吃醋,?
北青網(wǎng)2023-03-29 08:15:11
阿里巴巴美股漲超10%,,阿里六大業(yè)務(wù)獨(dú)立上市,詳細(xì)解讀來了,!
同花順2023-03-29 08:11:58
兒童感染甲流后哪些情況須就醫(yī)?不要盲目用藥
2023-03-29 08:15:52
坦克400實(shí)車被曝,,濃濃機(jī)甲風(fēng),!能成爆款?
網(wǎng)易2023-03-29 08:20:42
葛優(yōu)打“葛優(yōu)躺”官司6年獲賠759萬,,網(wǎng)友稱這才是真正的“躺賺”
2023-03-29 08:03:01
“青蛙賣崽”遇見城管撒腿就跑 游戲潮玩行為藝術(shù)
2023-03-29 08:19:10
研究:心跳快慢與壽命和疾病有關(guān)聯(lián) 超過80次/分要當(dāng)心
2023-03-29 08:09:31
專家稱不必按年齡退休:很多老年人是有工作意愿的
九派2023-03-29 08:17:02
拜登就田納西州校園槍擊案發(fā)表聲明,,以“冰淇淋玩笑”做開場白引怒批
觀察者網(wǎng)2023-03-28 17:05:57
李顯龍?jiān)L問廣州 “當(dāng)今中國已不是過去的中國”
綜合參考消息等2023-03-28 17:03:25
澳大利亞維多利亞州州長第七次訪華:不帶任何澳記者
觀察者網(wǎng)2023-03-28 17:51:27
姐弟墜亡案母親再發(fā)聲:悲劇不能再重演 他們必須死
光明網(wǎng)2023-03-29 08:07:28
挑戰(zhàn)者2,、豹2,、斯崔克...西方主戰(zhàn)裝備接連抵達(dá)烏克蘭
觀察者網(wǎng)2023-03-28 17:47:44
安理會未通過獨(dú)立調(diào)查“北溪”遭破壞決議,,俄方:早預(yù)料到
環(huán)球時(shí)報(bào)2023-03-28 17:30:57
男童穿醫(yī)生服去醫(yī)院輸液,,女護(hù)士:這“醫(yī)生”哪來的,?
新浪2023-03-29 08:01:57
90后養(yǎng)老新目標(biāo):盡快存夠100萬,,只想體面,、有尊嚴(yán)的老去
2023-03-29 08:20:10
教師人數(shù)或?qū)⒋鬁p, 三類人員無緣“鐵飯碗”, 師范生坐不住了 編制沒了
2023-03-29 08:12:01
歐洲航空公司受到新一輪罷工行動的打擊
看航空2023-03-28 17:10:06
法國反退休改革抗議持續(xù),,盧浮宮入口被堵,引發(fā)游客不滿
環(huán)球時(shí)報(bào)2023-03-28 17:36:08
被削減預(yù)算,,但諾格仍認(rèn)為MQ-8B無人機(jī)前景光明
看航空2023-03-28 17:20:51
美國空軍為軍用無人機(jī)開發(fā)人工智能面部識別技術(shù)
看航空2023-03-28 17:25:54
德意志銀行成風(fēng)暴眼 投資者宛若驚弓之鳥
第一財(cái)經(jīng)2023-03-28 17:04:12
土耳其首次展示其TB3無人戰(zhàn)機(jī)
看航空2023-03-28 17:06:56
馬英九拜謁南京中山陵 緬懷民主革命偉大先驅(qū)
央視新聞2023-03-28 17:56:47
超百位外企老總齊聚北京,,傳遞出什么信號?
上觀2023-03-29 08:07:57
美空軍自2023年起向新加坡輪換部署RQ-4無人機(jī)
看航空2023-03-28 17:21:59
特戰(zhàn)女兵化妝成空姐 瞬間“制服”男子 “千面女偵察”太帥了,!
上觀新聞2023-03-28 17:03:12
遭大V白嫖 試用期七天 第六天半被辭退!被坑了??!
超級學(xué)校霸王0092023-03-29 08:08:58
《秘密入侵》定檔6月21日!塞繆爾·杰克遜回歸 尼克·弗瑞對抗斯庫魯入侵,!
Lee奇奧哦2023-03-29 08:18:52
法英合作研制的未來巡航導(dǎo)彈計(jì)劃在2030年前交付
看航空2023-03-28 17:21:24
男子離家20年后回歸被拒,,兒子:當(dāng)年他翻墻私奔,!
河北廣電2023-03-29 08:04:27
比利時(shí)正式購買第二架A330-200MRTT
看航空2023-03-28 17:06:31