中國首個國產(chǎn)重組新冠病毒蛋白疫苗獲批上市
本報北京3月2日電記者張亞雄 從國家藥品監(jiān)督管理局獲悉,3月1日,,該局附條件批準安徽智飛龍科馬生物制藥有限公司的重組新型冠狀病毒蛋白疫苗(CHO細胞)上市注冊申請,。該疫苗是首個獲批的國產(chǎn)重組新冠病毒蛋白疫苗,適用于預防新型冠狀病毒感染所致的疾?。–OVID-19),。
根據(jù)《疫苗管理法》《藥品管理法》相關(guān)規(guī)定,國家藥監(jiān)局按照藥品特別審批程序進行應急審評審批,,附條件批準該疫苗上市注冊申請,。同時,要求該疫苗上市許可持有人繼續(xù)開展相關(guān)研究工作,,完成附條件的要求,,及時提交后續(xù)研究結(jié)果。
新冠肺炎疫情暴發(fā)后,,為了更大限度地提升疫苗研發(fā)成功率,,在梳理分析不同的技術(shù)基礎(chǔ)和可能性之后,我國科研攻關(guān)組按照滅活疫苗,、重組蛋白疫苗,、腺病毒載體疫苗、減毒流感病毒載體活疫苗,、核酸疫苗5條技術(shù)路線推進研究,。其中,重組蛋白疫苗是通過基因工程的方式在工程細胞內(nèi)表達純化病原體抗原蛋白并制備成疫苗,,安全性較高,。
2020年4月14日,我國重組蛋白疫苗完成毒種構(gòu)建,,開展細胞和毒種鑒定和遺傳穩(wěn)定性考察,、動物攻毒實驗和安全性評價實驗。近期,,經(jīng)國務院聯(lián)防聯(lián)控機制批準,,我國開始部署序貫加強免疫接種,重組新型冠狀病毒蛋白疫苗也在選擇范圍內(nèi)。
(責任編輯:孫啟浩 CN037)
推薦閱讀

黑龍江省全國人大代表團抵京
視覺中國2022-03-03 14:14:45
工信部:未經(jīng)用戶同意不得自動或強制下載APP
人民日報客戶端2022-03-03 13:55:16
中方提醒美方:還錢不是慷慨是天經(jīng)地義
央視新聞2022-03-03 13:54:48
普京告訴莫迪烏方用印留學生作人盾 阻止他們離開烏克蘭進入俄羅斯
參考消息2022-03-03 13:20:30
多地氣溫明顯偏高 北方今年首場沙塵將來襲
中國天氣網(wǎng)2022-03-03 13:55:58
美軍推遲試射民兵3洲際導彈 稱為避免造成誤解
海外網(wǎng)2022-03-03 14:16:24
臺灣多縣市上午無預警大停電 路口紅綠燈未亮 診所受影響
環(huán)球網(wǎng)2022-03-03 10:19:12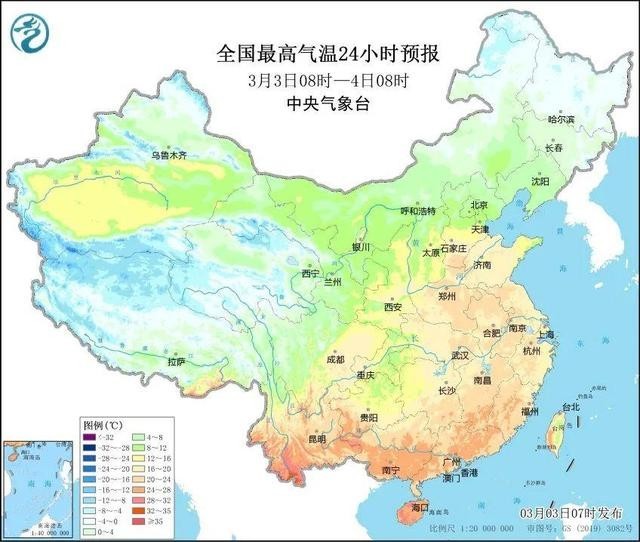
北方今年首場沙塵來襲 乍暖還寒不要隨意脫減冬衣
北京日報2022-03-03 14:25:29
為何美國拒絕在烏克蘭設(shè)立禁飛區(qū)
環(huán)球網(wǎng)2022-03-03 10:22:20
俄大使稱不排除俄英中斷外交關(guān)系 俄羅斯人恐遭驅(qū)逐
北京日報2022-03-03 10:52:55
中方談美挪用70億美元阿富汗資產(chǎn):嚴重違反國際法
每日經(jīng)濟新聞2022-03-03 13:36:51
歐盟委員會主席談烏克蘭入盟:必須結(jié)束戰(zhàn)事
2022-03-03 11:00:23
人大代表建議針對網(wǎng)絡(luò)暴力進行立法 加大網(wǎng)暴處罰力度
人民日報2022-03-03 13:27:46
臺媒稱美代表團竄訪遭島內(nèi)網(wǎng)友譏諷
參考消息2022-03-03 14:42:13
“北溪2號”運營商被曝申請破產(chǎn) 俄方回應
海外網(wǎng)2022-03-03 11:08:36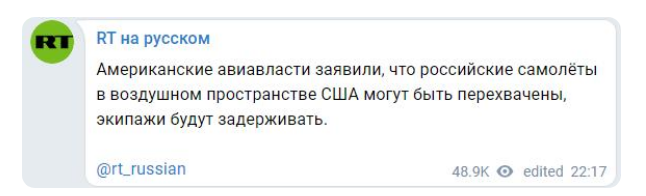
俄媒:俄飛機在美領(lǐng)空或被攔截
環(huán)球網(wǎng)2022-03-03 11:05:34
聯(lián)合國難民署新聞發(fā)言人:約68萬人逃離烏克蘭
環(huán)球時報2022-03-03 10:22:07
俄烏雙方軍事?lián)p失如何,?美國官員這樣說
環(huán)球網(wǎng)2022-03-03 14:39:45
德國“歷史性轉(zhuǎn)變”背后……
參考消息2022-03-03 10:18:50
全國人大代表王亞平太空履職很自豪 籌備天宮課堂
人民網(wǎng)2022-03-03 10:30:28
女子超市掉包條形碼1元買2斤草莓 警方認定是慣犯
快科技2022-03-03 13:32:21
蔡英文見蓬佩奧網(wǎng)絡(luò)直播因停電取消 被噓用愛發(fā)電
環(huán)球網(wǎng)2022-03-03 14:07:19
烏官員稱澤連斯基遭車臣暗殺未遂
2022-03-03 11:02:03
拜登因俄烏危機修改國情咨文演講內(nèi)容
參考消息2022-03-03 14:23:07
竄訪臺灣,,一場嘩眾取寵的鬧劇
人民日報2022-03-03 10:06:57
為何俄烏沖突俄空天軍“異常表現(xiàn)讓專家困惑”,?
環(huán)球時報2022-03-03 14:13:44
蘋果將于3月9日召開新品發(fā)布會 iPhone首次支持5G
金融界2022-03-03 11:50:40
阿布決定出售切爾西 捐贈所有收益建立慈善基金會
文匯報2022-03-03 12:08:47
臺灣無預警大停電 引發(fā)交通混亂再陷“世界末日”
央視網(wǎng)2022-03-03 14:09:22
美國已向烏克蘭提供數(shù)百枚毒刺導彈 首次直接提供
環(huán)球網(wǎng)2022-03-03 11:09:04
多位代表委員:雙減后老師負擔增加 評比檢查有增無減
上觀新聞2022-03-03 13:14:18
臺媒:大陸3艘軍艦現(xiàn)身蘭嶼外海 4天內(nèi)第三次
環(huán)球網(wǎng)2022-03-03 14:38:00
俄外長:烏克蘭方面正按美國要求拖延俄烏談判
齊魯壹點2022-03-03 11:15:19
上海新增5本土病例 均為松江滬亭北路永輝超市員工
北京晚報2022-03-03 13:51:17
白俄要軍事介入烏局勢,?美國防部:沒看到這一跡象
環(huán)球網(wǎng)2022-03-03 10:26:07