元素周期表是否應(yīng)重新設(shè)計,?英媒:或?qū)⒊蔀榫o迫工作
原標(biāo)題:元素周期表是否應(yīng)重新設(shè)計?英媒:或?qū)⒊蔀榫o迫工作
參考消息網(wǎng)3月2日報道 英媒稱,,有人懷疑現(xiàn)在的元素周期表是否是最佳排列方式,。
據(jù)英國《新科學(xué)家》周刊網(wǎng)站2月26日報道,目前,,化學(xué)元素是根據(jù)原子核中的質(zhì)子數(shù)來排列,。而且,元素性質(zhì)主要是由核外電子的排布所決定的,。
最輕的元素只有一個電子層,,較重的元素?fù)碛懈嚯娮訉印U嬲龥Q定每種元素性質(zhì)的是最外層電子數(shù),。
元素周期表的排列與外層電子數(shù)相關(guān),,即具有相同屬性的元素被安排在同一族。例如,,第一族元素的最外層電子數(shù)為1,,第二族元素的最外層電子數(shù)為2。但它們并不是總能如此完美地匹配,。
1.氫應(yīng)該在哪里,?
氫的最外層電子數(shù)為1,因此人們可以認(rèn)為它確實應(yīng)該排在這個位置,,即在第一族內(nèi),,排在同樣只有一個外層電子的鋰和鈉之后。然而,,氫是氣體,,不是金屬,因此它的屬性并不匹配,。
氫的最外層只有一個電子,,它只需得到一個電子即可達(dá)到穩(wěn)定狀態(tài),因此,,它是一種活潑性很強(qiáng)的元素,,從這個意義上說,它與第17族元素更接近,,也就是像氯一樣的鹵族元素,。這些元素都只需要獲得一個電子即可達(dá)到穩(wěn)定狀態(tài)。就其性質(zhì)而言,,氫更接近氯而不是鋰,。
2.為什么汞和金如此怪異,?
汞在室溫下呈液態(tài)。從這個意義上說,,它與第12族的其他成員完全不同,,它們都是固體金屬。
在元素周期表中,,越往后的元素,,原子核中質(zhì)子所帶正電荷數(shù)就越多。這會對核外電子產(chǎn)生更大的吸力,,意味著它們必須以越來越快的速度運(yùn)行,。根據(jù)愛因斯坦的相對論,這會導(dǎo)致它們的實際質(zhì)量遠(yuǎn)遠(yuǎn)大于電子的正常質(zhì)量,,從而增加內(nèi)向拉力,。汞的電子運(yùn)行速度高達(dá)光速的58%,如此緊密的運(yùn)行使它們無法與別的原子發(fā)生聯(lián)系,,從而無法成為固體,。同樣的道理也解釋了為什么金是金色,它是金屬中一種獨(dú)特的顏色:相對論效應(yīng)改變了電子吸收光的方式,。
推薦閱讀

美國夏威夷兩座火山持續(xù)噴發(fā) 當(dāng)?shù)嘏沙鰢窬l(wèi)隊
海外網(wǎng)2022-12-07 10:57:27
美國批準(zhǔn)向波蘭出售總價值達(dá)37.5億美元的武器裝備
央視新聞客戶端2022-12-07 10:49:40
西班牙點球大戰(zhàn)遭淘汰 葡萄牙大勝瑞士晉級
新華網(wǎng)2022-12-07 10:05:29
布林肯發(fā)涉中國防疫言論 中方回應(yīng) 這幾年中國疫情防控方針政策是正確,、科學(xué),、有效的
環(huán)球網(wǎng)2022-12-07 09:36:02
辭職后連夜逃亡的貪官出鏡痛哭:東窗事發(fā),,一逃了之
2022-12-07 10:17:09
卡塔爾世界杯8強(qiáng)全部出爐 黑馬只有一匹:摩洛哥
2022-12-07 11:15:51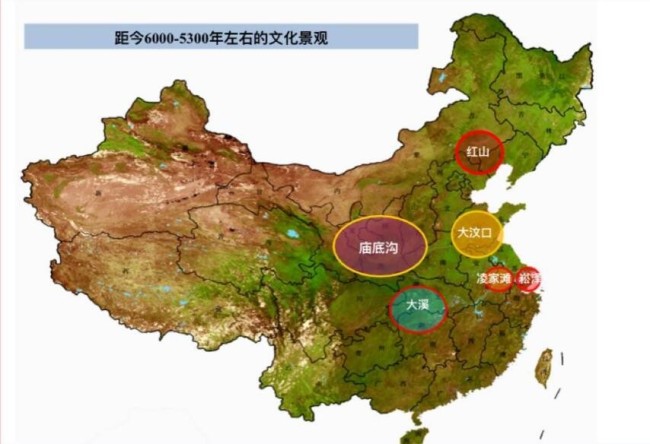
美雜志:中國發(fā)現(xiàn)5000年前房屋遺址 人工壕溝等設(shè)施展現(xiàn)軍事實力
環(huán)球網(wǎng)2022-12-07 11:03:30
新冠康復(fù)女孩:終于敢承認(rèn)自己陽過 不好意思曾很壓抑自己
2022-12-07 11:02:35
韓國財閥與前總統(tǒng)女兒離婚 并承認(rèn)自己有婚外子女
海外網(wǎng)2022-12-07 09:41:49
俄媒:澤連斯基正拍賣烏克蘭,美國只能借機(jī)收割歐洲資本
騰訊網(wǎng)2022-12-07 09:07:33
臺積電赴美設(shè)廠引多重疑慮 島內(nèi)普遍擔(dān)心臺灣將被掏空
環(huán)球時報2022-12-07 10:30:14
2023年元旦放假安排來了,!元旦放假安排:3天假不調(diào)休
2022-12-07 11:07:11
男子買餅需求全被老板說服,?網(wǎng)友:沒見過這樣的pua!
2022-12-07 10:17:45
金毛眼球被摳流落街頭被救后離世 多狠毒的心下得去手呢
2022-12-07 10:13:10
胡錫進(jìn):我不相信這個國家里會有絕對反對放開封控的人
胡錫進(jìn)2022-12-07 09:44:10
朝鮮連續(xù)實彈射擊反制韓美軍演 韓軍多次向朝鮮發(fā)出警告
環(huán)球網(wǎng)2022-12-07 09:33:53
大雪節(jié)氣誰是真正下雪王 烏魯木齊出人意料奪冠軍
2022-12-07 10:27:16
曝李四川接受邀請將出任臺北副市長 在蔣萬安“三顧茅廬”之后已決定接受蔣邀請
中國臺灣網(wǎng)2022-12-07 09:29:51
烏媒:澤連斯基發(fā)視頻,透露自己在頓巴斯地區(qū) ,,慶祝烏克蘭“建軍節(jié)”
新京報2022-12-07 09:11:19
俄總統(tǒng)新聞秘書:普京經(jīng)常親自駕車 他常開一輛小電動汽車
中新網(wǎng)2022-12-07 10:40:51
外交部回應(yīng)朔爾茨文章涉華表態(tài) 孤立中國、限制對華合作不符合任何一方利益
新京報2022-12-07 10:57:57
景區(qū)回應(yīng)多人推山頂“風(fēng)動石”:景區(qū)特色 允許推
新京報2022-12-07 10:10:15
坐滿士兵的俄軍BMP-2步兵戰(zhàn)車觸雷爆炸畫面曝光:大量步兵撤退
環(huán)球網(wǎng)2022-12-07 11:09:44
康復(fù)患者:我終于敢承認(rèn)自己陽過
2022-12-07 10:35:40
男孩時隔4個月見父母禮貌喊叔叔 引發(fā)無數(shù)父母感慨
2022-12-07 10:21:11
烏克蘭為何要深入俄腹地空襲,?俄羅斯本土連續(xù)兩天遭襲!
上觀新聞2022-12-07 10:34:14
恩師希望梅西拿到世界杯后就退役:那是最好的結(jié)局
2022-12-07 10:41:41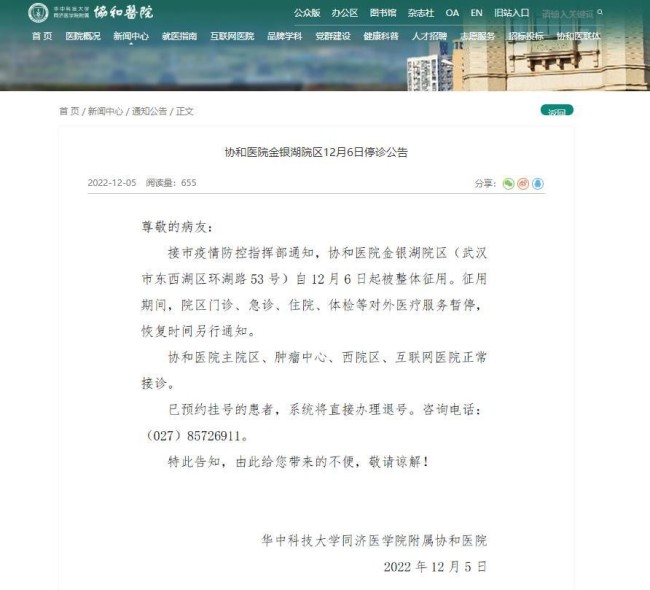
武漢協(xié)和醫(yī)院金銀湖院區(qū)被整體征用 已在該院區(qū)預(yù)約掛號的患者,,系統(tǒng)將直接辦理退號
央廣網(wǎng)2022-12-07 09:37:28
多地零售藥店布洛芬和泰諾林售罄,多方回應(yīng),!
2022-12-07 10:40:14
以色列海上新盾“C-穹頂”問世
海洋防務(wù)前沿2022-12-07 09:21:45
落馬區(qū)委書記貪腐上億元,,被判19年,!剛當(dāng)區(qū)長就安排2人伺候
2022-12-07 10:10:05
權(quán)威專家:別怕發(fā)熱 像感冒一樣對待,!要轉(zhuǎn)變防控重點
2022-12-07 11:11:44
男子醉駕致2死1傷卻渾然不知 不知道毀了幾個家庭
2022-12-07 10:50:38
俄軍裝備“上新” 新一批蘇-35S戰(zhàn)機(jī)即將抵達(dá),開足馬力生產(chǎn)了
央視網(wǎng)2022-12-07 09:18:01
曝賴清德對接任民進(jìn)黨主席猶豫不決 民進(jìn)黨各派系明爭暗斗
海峽導(dǎo)報2022-12-07 09:27:44

















