當前位置:新聞 > 正文
澳研究人員發(fā)現(xiàn)治療阿爾茨海默病的新靶點
新華社堪培拉7月10日電(記者岳東興白旭)澳大利亞弗林德斯大學日前發(fā)布公報說,,抑制一種名為Tau蛋白的蛋白質病變,可避免對腦細胞產(chǎn)生毒性作用而導致記憶功能受損,,這有望成為治療阿爾茨海默病的新靶點,。
阿爾茨海默病是一種神經(jīng)系統(tǒng)退行性疾病,臨床上以記憶障礙,、失語,、執(zhí)行功能障礙以及人格和行為改變等為特征,病理特征包括β淀粉樣蛋白沉積和Tau蛋白過度磷酸化,,病因迄今尚不明確,。新研究通過體外細胞實驗和動物實驗解釋了Tau如何過度磷酸化的原因,從而為治療Tau病變提供信息,。相關研究成果已發(fā)表在美國《科學進展》雜志上,。
弗林德斯大學領銜的研究團隊首先選取了多達20個不同的Tau磷酸化位點和12種蛋白激酶進行實驗。蛋白激酶是指催化蛋白質磷酸化過程的酶,蛋白激酶靶向Tau的特定位點是磷酸化位點,。
結果發(fā)現(xiàn),,Tau磷酸化位點之間存在相互依賴性聯(lián)系,這意味著一個位點的磷酸化易促使另一個位點磷酸化,,并且在這些位點中還存在一些“主位點”,,即這些位點的磷酸化能影響Tau其他大多數(shù)位點的磷酸化。
為了探究是否可以靶向這些“主位點”來減少阿爾茨海默病中Tau的毒性,,以改善記憶功能,,研究人員進行了小鼠實驗。結果發(fā)現(xiàn),,當小鼠的Tau蛋白缺失某個特定的“主位點”時,,它們沒有出現(xiàn)記憶缺陷。
研究人員表示,,新發(fā)現(xiàn)具有治療涉及Tau蛋白的一系列神經(jīng)系統(tǒng)疾病的潛力,,包括帕金森病、腦震蕩引起的慢性腦損傷和中風,,未來將進一步了解這些“主位點”在健康和疾病中的作用,。
推薦閱讀

英國新首相之爭拉開帷幕多人加入角逐
新華網(wǎng)2022-07-10 10:21:40
美國執(zhí)法人員騎馬揮鞭驅逐移民調查公布結果
新華網(wǎng)2022-07-09 16:21:35
英媒:約翰遜辭職不走人,,是想在官邸辦婚禮?
新華網(wǎng)2022-07-09 12:31:01
安倍94歲母親得知兒子中槍放聲大哭 當時正吃午飯
海外網(wǎng)2022-07-09 11:48:34
俄國防部:摧毀烏軍2套“魚叉”反艦導彈系統(tǒng)
海外網(wǎng)2022-07-09 09:52:03
奧巴馬就安倍遭槍擊身亡表態(tài):震驚悲傷 表達哀悼
和訊網(wǎng)2022-07-09 10:03:52
安倍死因公布:動脈損傷致失血過多 12日將舉行葬禮
海外網(wǎng)2022-07-09 09:48:54
日本防衛(wèi)?。簶寶脖断臃附邮苓^實彈射擊訓練
海外網(wǎng)2022-07-09 09:41:34
槍殺安倍嫌犯:本想用自制炸彈殺人 實驗后改用槍擊
海外網(wǎng)2022-07-09 09:44:39
俄國防部:摧毀烏軍1處存放美國M777榴彈炮軍火庫
海外網(wǎng)2022-07-10 01:01:57
老人被3名年輕人攔截起哄 警方通報:4人全部到案
北京日報2022-07-09 13:19:25
武警四川總隊組織特戰(zhàn)偵察比武競賽
央視軍事2022-07-09 15:28:01
英媒:美國數(shù)十年來一直為烏克蘭培訓高級軍官
央視新聞客戶端2022-07-09 09:35:21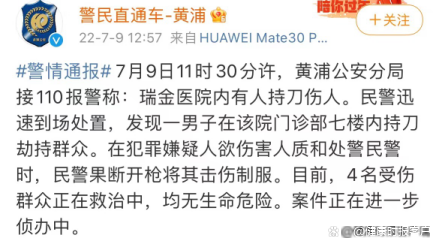
瑞金醫(yī)院發(fā)生持刀傷人事件 醫(yī)生陶勇建議醫(yī)院盡快安裝安檢設備
健康時報客戶端2022-07-10 09:32:45
山東臨沂3天120人感染 多數(shù)是學生 暫定線下教學培訓
重慶晨報2022-07-09 15:33:13
嫌犯稱因安倍與宗教團體有關而槍擊 本打算用自制炸彈
北京日報2022-07-09 10:45:24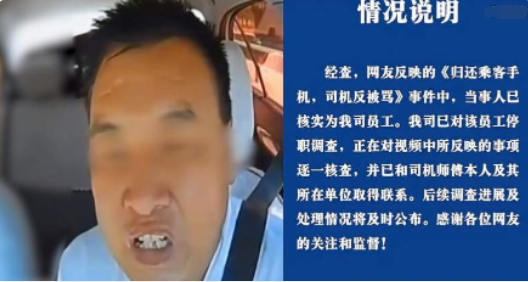
威脅司機的航天科工員工被停職 已和司機取得聯(lián)系
中國網(wǎng)2022-07-09 11:14:08
美國宣布將再向烏克蘭提供4億美元的軍事援助
央視新聞客戶端2022-07-10 11:00:49
凌晨時分,,防空武器驟然開火!
東部戰(zhàn)區(qū)2022-07-09 15:32:24
美媒鼓吹美日打造“技術聯(lián)盟”抗衡中國
參考消息2022-07-08 05:38:13
槍擊案嫌犯稱最初目標并非安倍而是宗教團體干部
央視新聞客戶端2022-07-10 09:21:43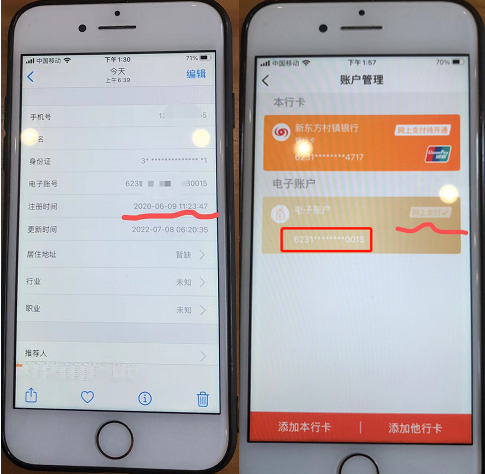
河南村鎮(zhèn)銀行賬戶現(xiàn)3000萬詭異資金 不明資金進出
鳳凰網(wǎng)2022-07-09 11:38:47
59名淮海戰(zhàn)役犧牲烈士,,集中遷葬入陵
央視軍事2022-07-09 15:35:43
載有安倍遺體的靈車已抵達東京住宅
海外網(wǎng)2022-07-09 13:32:50
日媒:安倍遭槍擊現(xiàn)場有22人警備 包括7名警方特警
海外網(wǎng)2022-07-09 11:45:59
烏克蘭基輔市長宣布開展市民軍事訓練計劃
央視新聞客戶端2022-07-10 11:02:55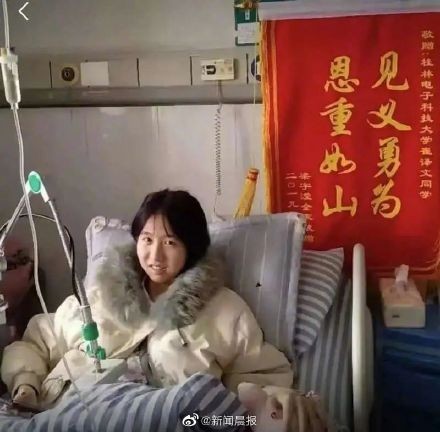
打耳洞都怕疼的姑娘為同學擋了8刀 硬漢父親落淚
光明網(wǎng)2022-07-09 15:17:08
唐山房價怎么就撐不住了 陰跌數(shù)月豪宅虧本大甩賣
濟南日報2022-07-09 14:08:24
韓國總統(tǒng)尹錫悅命令軍方:若朝鮮挑釁迅即對其懲罰
參考消息2022-07-08 05:44:34
安倍槍擊案嫌疑人供認 最初襲擊目標并非安倍晉三
央視新聞客戶端2022-07-10 11:05:59
視頻:80秒看斯里蘭卡大抗議6個時間節(jié)點
海客新聞2022-07-10 09:46:53
斯里蘭卡抗議者硬闖總統(tǒng)府 警察噴催淚瓦斯驅趕
海外網(wǎng)2022-07-10 09:53:06
為秘密行動準備,?美軍演練核潛艇投送特種部隊
參考消息2022-07-08 05:35:53
西媒盤點:烏克蘭想要但西方絕不會提供的先進武器
參考消息2022-07-08 05:43:11
拜登授權縮減最多4億美元的國防支出以援助烏克蘭
央視新聞客戶端2022-07-09 09:54:54

















