新藥來了,!這一無法治愈的疾病有救了,?(4)
王莉二十多年的藥企生涯中,一直參與阿爾茨海默病相關(guān)藥物的研發(fā)工作,。她表示,,每一款新藥的誕生都是一場“長征”,。從臨床前研究到臨床試驗,再到最終的上市批準,,通常需要10余年時間,,耗資數(shù)十億美元,過程極其復(fù)雜,。
多奈單抗的獲批之路并不平坦,。2021年10月,禮來首次向FDA遞交了多奈單抗的上市申請,,尋求加速批準,。2023年1月,F(xiàn)DA以申請中用藥至少12個月的患者數(shù)量不足為由,,拒絕了這項申請,。隨后,補充了更多數(shù)據(jù)后,,禮來再次向FDA提交申請,,并最終于2023年7月獲得批準?!岸Y來在阿爾茨海默病的研發(fā)領(lǐng)域耕耘了超過35年,,經(jīng)歷了無數(shù)次失敗,最終才收獲了多奈單抗這款新藥,?!蓖趵蛘劦馈?/p>
據(jù)世衛(wèi)組織2023年3月公布的數(shù)據(jù),,全球范圍內(nèi),,有超過5500萬人患癡呆癥。阿爾茨海默病是癡呆癥中最常見的類型,,占所有病例的60%—70%。據(jù)《中國阿爾茨海默病報告2024》,,2021年國內(nèi)有超過1699萬人,,正遭受阿爾茨海默病及其他癡呆癥的困擾。
面對龐大的患病人群,,全球藥企已在這場攻堅戰(zhàn)中投入了數(shù)千億美元,。然而,,阿爾茨海默病的新藥研發(fā)就像在迷霧中苦苦尋找一把通向記憶之門的鑰匙,雖然投入巨大,,卻鮮有人能真正打開那扇門,。多項研究表明,這一領(lǐng)域的新藥研發(fā)失敗率超過90%,,因此,,也被業(yè)內(nèi)形象地稱為“研發(fā)黑洞”。
牛津大學醫(yī)院國民保健服務(wù)基金會信托基金高級臨床研究員伊萬·科伊切夫告訴《中國新聞周刊》,,盡管阿爾茨海默病領(lǐng)域已有多次嘗試,,但大部分臨床試驗最終以失敗告終。造成這些失敗的主要原因有兩點:一是許多臨床試驗選擇的是病變已嚴重的阿爾茨海默病患者,,治療效果受到極大限制,;二是大多數(shù)藥物基于單一病因研發(fā),但癡呆癥的病因復(fù)雜且多樣,。
推薦閱讀
“餓瘦和運動瘦的區(qū)別”引熱議!減肥專家說……
中青網(wǎng)2025-03-23 14:14:56
無理取鬧,、惡意辱罵熱線工作人員,!代某,被拘
法治時報2025-03-23 14:01:52
中國福彩提醒:AI預(yù)測彩票號碼,,100%是騙局
央視新聞客戶端2025-03-23 13:34:47
學者:下周或成決定韓國命運的一周 三連發(fā)審判引關(guān)注
網(wǎng)易2025-03-23 19:03:21
AI能預(yù)測彩票中獎號碼?假 100%是騙局
百家號2025-03-24 08:09:01
俄烏將分別與美會談 這次能否促和 ?;鹋c糧食協(xié)議成焦點
央視新聞2025-03-24 08:04:33
加沙政府新領(lǐng)導(dǎo)人上任5天即身亡 以軍空襲醫(yī)院致其死亡
中國網(wǎng)2025-03-24 08:06:41
身藏15公斤黃金走私 印度女演員被捕
環(huán)球時報2025-03-24 08:10:16
男子用隔夜飯做炒飯吃完臟器衰竭 警惕4大隱形殺手
灑哥看電影2025-03-24 08:02:40
臺積電2nm制程良率已超60% 預(yù)計明年量產(chǎn)供應(yīng)蘋果
新浪財經(jīng)2025-03-24 07:58:51
大V:普京的目標遠不止于烏克蘭 重塑全球秩序
王冰汝2025-03-23 19:03:05
美軍六代機F-47為何采用鴨翼布局 態(tài)度反轉(zhuǎn)背后
高峰軍事觀察2025-03-23 20:05:29
美國六代機終于不是PPT了嗎 F-47將主宰天空
海報新聞2025-03-24 07:34:31
裁罰柯 陳智菡怒批“監(jiān)院”頭殼壞掉心黑
中評網(wǎng)2025-03-23 19:24:44
澤連斯基呼吁向普京施壓實現(xiàn)停火 外交豪賭危機四伏
搜狐軍事2025-03-24 07:36:27
烏克蘭一警察大樓發(fā)生爆炸 致1死多傷
環(huán)球網(wǎng)2025-03-24 08:02:24
以色列股市全線大跌 中東局勢緊張引發(fā)全球股市跳水
捏一下2025-03-24 07:36:49
美六代機合同為何沒給洛克希德馬丁 避免一家獨大
百家號2025-03-23 19:04:05
F1中國站三人取消成績 賽車未達標影響排名
北晚在線2025-03-24 08:08:46
美國6代機真的不是5.5代嗎 性能落后引發(fā)質(zhì)疑
軍情作家陳曦2025-03-24 07:34:04
大V:菲律賓“拉印抗華”錯判形勢 印度未予理會
力波觀察2025-03-23 19:01:38
專家:看了F-47之后殲-36放心了 美國六代機疑慮重重
杜文龍2025-03-23 19:05:27
太火!這個行業(yè)招人像"春運搶票" AI人才成香餑餑
新民晚報2025-03-24 08:10:56
真實有效需求是數(shù)字金融發(fā)展的動力 遵循金融業(yè)務(wù)規(guī)律
東方財富網(wǎng)2025-03-24 08:00:02
寒潮真要來了!這些地方降溫或超20℃ 從熱浪到驟冷
新華網(wǎng)2025-03-24 08:10:35
臺機構(gòu)疑妨礙綠民代罷免案連署遭批 中選會遲不公布結(jié)果引質(zhì)疑
海峽導(dǎo)報2025-03-23 20:04:16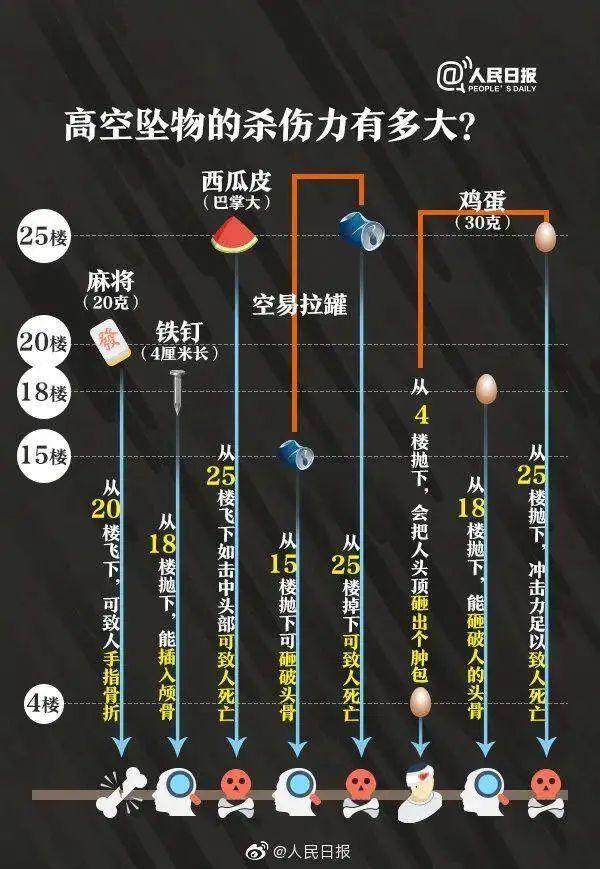
小孩丟下一團濕巾 家長賠償7000 高空拋物引發(fā)社區(qū)關(guān)注
光明網(wǎng)2025-03-24 08:07:07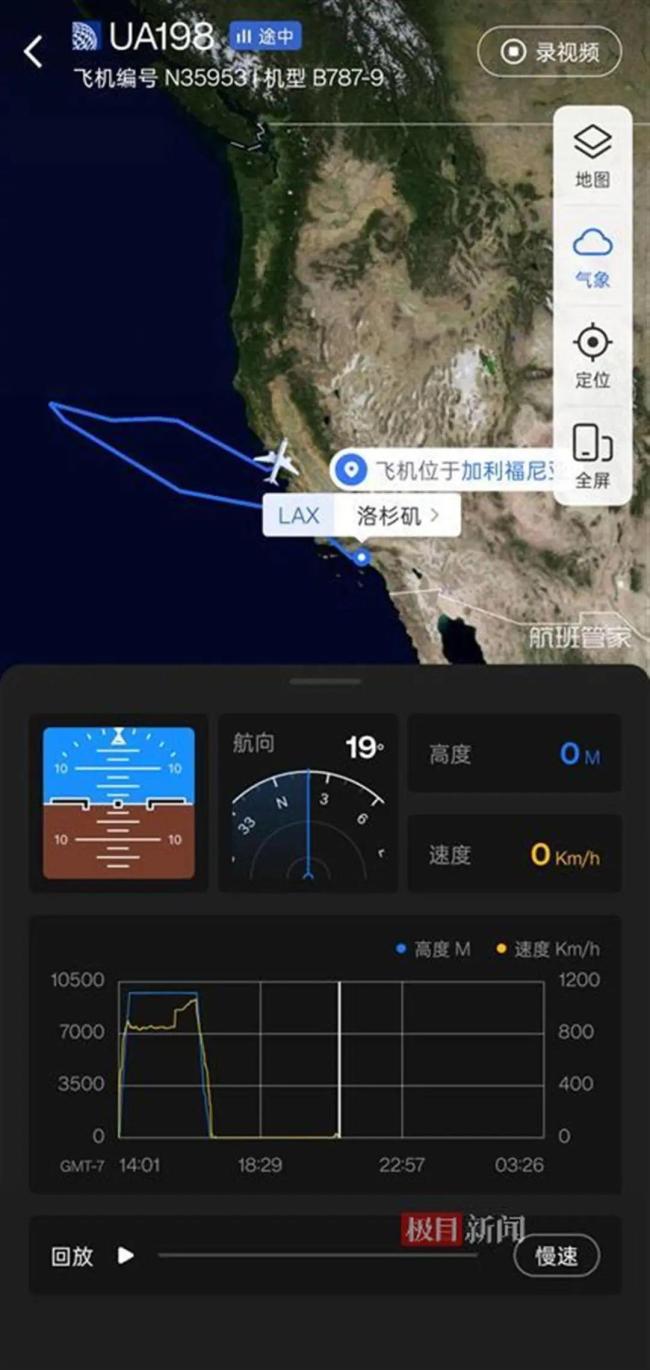
美聯(lián)航客機起飛2小時折返 機長忘帶護照
環(huán)球網(wǎng)2025-03-24 08:00:24
海漂一天一夜的小孩哥戰(zhàn)績可查 頑童阿亮意外走紅網(wǎng)絡(luò)
熠昕悅讀2025-03-24 08:00:48
特朗普說只有他能阻止普京 自認有獨特能力
環(huán)球時報2025-03-24 08:11:11
島內(nèi)統(tǒng)派、陸配連遭追殺,!紀欣:警惕賴清德造成的寒蟬效應(yīng)
臺海網(wǎng)2025-03-23 19:05:43
伊朗稱當前已不可能再與美國談判 除非局勢變化
京報網(wǎng)2025-03-24 07:53:37
法媒:法國爆發(fā)數(shù)萬人集會 反對種族主義和極右翼
參考消息2025-03-23 19:01:12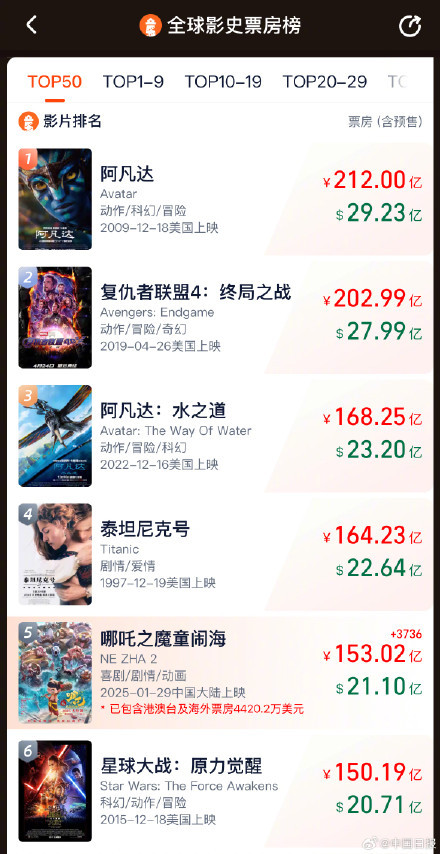
哪吒2票房超153億 小吒兒太爭氣了!
光明網(wǎng)2025-03-24 08:09:13
8秒01!吳艷妮打破全國紀錄 刷新塵封11年紀錄
北晚在線2025-03-24 08:09:25