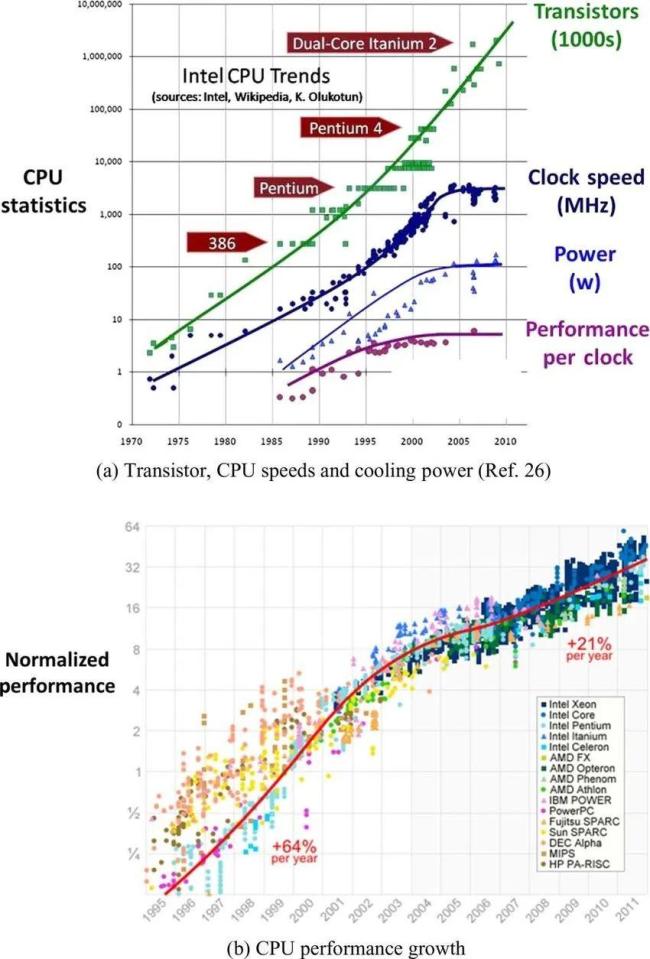
醫(yī)保藥監(jiān)部門回應(yīng)集采藥品相關(guān)問題 調(diào)研揭示真實情況(2)
關(guān)于“內(nèi)鏡檢查腸道準(zhǔn)備的瀉藥在臨床使用中經(jīng)常有反映療效不佳”的說法,,經(jīng)了解,,用于腸道準(zhǔn)備的瀉藥主要是復(fù)方聚乙二醇電解質(zhì)散劑,,此藥是第十批集采新納入的品種,目前尚處于落地執(zhí)行前的準(zhǔn)備階段,。瑞金醫(yī)院及其他幾家醫(yī)院均未收到臨床一線關(guān)于“瀉藥不瀉”的反饋。某三甲醫(yī)院結(jié)直腸外科主任表示,,多年來做腸鏡準(zhǔn)備的兩種瀉藥都是國產(chǎn)藥,,沒有變化,,沒聽說過“瀉藥不瀉”的情況。
對于臨床收集到的不良反應(yīng)個例,,7家醫(yī)院均按規(guī)定報告了藥品不良反應(yīng),,報告渠道暢通。其中部分醫(yī)院進(jìn)一步提供了詳細(xì)報告情況,,集采的仿制藥和原研藥不良反應(yīng)均未超出藥品說明書和文獻(xiàn)報道的范圍,。
此次關(guān)于“血壓不降、麻藥不睡,、瀉藥不瀉”等說法,,多來自他人轉(zhuǎn)述和主觀感受。下一步,,有關(guān)部門將持續(xù)關(guān)注,。一位臨床專家表示,對制藥行業(yè)特別是對仿制藥行業(yè)不夠了解,,容易產(chǎn)生“價格等于質(zhì)量”,、“降價就一定降質(zhì)”的認(rèn)識誤區(qū)。
從2015年開始,,我國推進(jìn)藥品審評審批制度改革,,將仿制藥由原來的“仿已有國家標(biāo)準(zhǔn)的藥品”調(diào)整為“仿與原研藥品質(zhì)量和療效一致的藥品”。嚴(yán)格遴選一致性評價參比制劑,,一般選擇原研藥品作為參比制劑,,所有仿制藥都以參比制劑作為對照。我國的一致性評價方法采用了國際公認(rèn)的嚴(yán)格標(biāo)準(zhǔn),,采納國際人用藥品注冊技術(shù)協(xié)調(diào)會(ICH)等國際通行技術(shù)標(biāo)準(zhǔn)開展仿制藥的技術(shù)審評,。藥品過評上市后持續(xù)受到嚴(yán)格監(jiān)管,要求企業(yè)嚴(yán)格按照申請一致性評價時的工藝生產(chǎn),,重大變更須重新審批,。
有人稱原研藥品全面退出中國,事實并非如此,。中國是全世界最重要的原研藥市場之一,,也是最開放的原研藥市場之一。在2018年以來的國家醫(yī)保目錄談判中,,進(jìn)口藥品有212個談判成功,,占談判西藥的近50%。即使在競爭激烈的藥品集中帶量采購中,,也有30多種原研藥中標(biāo),。藥品集采政策鼓勵原研藥與仿制藥同臺競爭,即使沒有中選,,原研藥也不會被禁止使用,。集采藥品的協(xié)議采購量為醫(yī)療機(jī)構(gòu)報告需求量的60%-80%,,醫(yī)院實際采購量達(dá)到相應(yīng)規(guī)模即為完成采購協(xié)議,協(xié)議之外的部分,,由醫(yī)療機(jī)構(gòu)自主選擇品牌,,可以選擇采購非中選原研藥。
相關(guān)新聞
醫(yī)保及藥監(jiān)部門回應(yīng)集采藥品問題 質(zhì)量有保障
2025-02-09 16:35:30醫(yī)保及藥監(jiān)部門回應(yīng)集采藥品問題藥監(jiān)部門回應(yīng)集采藥品問題 調(diào)研揭示真實情況
今年1月,,有專家認(rèn)為某些集采藥品可能存在“血壓不降,、麻藥不睡、瀉藥不瀉”的質(zhì)量風(fēng)險,,有關(guān)部門派員進(jìn)行了調(diào)研
2025-02-09 21:00:35藥監(jiān)部門回應(yīng)集采藥品問題醫(yī)保藥監(jiān)部門回應(yīng)血壓不降麻藥不睡 集采藥品質(zhì)量有保障
2025-02-09 17:16:47醫(yī)保藥監(jiān)部門回應(yīng)血壓不降麻藥不睡血壓不降、麻藥不睡,?藥監(jiān)部門就集采藥品問題答問
2025-02-09 15:34:43血壓不降,、麻藥不睡,、瀉藥不瀉?醫(yī)保,、藥監(jiān)部門就集采藥品問題答問集采藥品中選價能否覆蓋成本,?醫(yī)保、藥監(jiān)部門回應(yīng):企業(yè)反饋積極
近日,,醫(yī)保部門和藥監(jiān)部門的有關(guān)人員就集采藥品相關(guān)問題接受了采訪
2025-02-13 10:37:20集采藥品中選價能否覆蓋成本醫(yī)保藥監(jiān)回應(yīng)血壓不降麻藥不睡 集采藥品質(zhì)量受保障
近日,,有關(guān)集采藥品“血壓不降、麻藥不睡,、瀉藥不瀉”的傳言引發(fā)關(guān)注,。醫(yī)保和藥監(jiān)部門對此進(jìn)行了回應(yīng)
2025-02-09 18:02:34醫(yī)保藥監(jiān)回應(yīng)血壓不降麻藥不睡